cho 1.41 gam hỗn hợp 2 kim loại al và mg tác dụng với dung dịch h2so4 1.96 % vừa đủ thu được 1568 ml ở đktc . a, tính c% của chất có trong dung dịch thu được sau phản ứng . b.bằng phương pháp hóa học tách riêng mg ra khỏi hỗ hợp . viết PTHH

Những câu hỏi liên quan
cho 1.41 gam hỗn hợp 2 kim loại al và mg tác dụng với dung dịch h2so4 1.96 % vừa đủ thu được 1568 ml ở đktc .
a, tính c% của chất có trong dung dịch thu được sau phản ứng .
Ta có pthh
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (1)
Mg + H2SO4 \(\rightarrow\) MgSO4 + H2 (2)
Theo đề bài ta có
VH2=1568 ml =1,568 l
-> nH2=\(\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
Gọi x là số mol của H2 tham gia vào pthh 1
Số mol của H2 tham gia vào pthh2 là 0,07 -x mol
Theo pthh 1 và 2 ta có
nAl=2/3 nH2=2/3x mol
nMg=nH2=(0,07-x) mol
Theo đề bài ta có hệ pt
27.2/3x + 24.(0,07-x)=1,41
\(\Leftrightarrow\) 18x + 1,68 - 24x = 1,41
\(\Leftrightarrow\) -6x = -0,27
-> x= 0,045 mol
-> nAl=2/3.0,045=0,03 mol
nMg=(0,07-0,045)=0,025 mol
Ta có
nH2SO4 (1) và (2) = nH2 = 0,07 mol
-> mct=mH2SO4=0,07.98=6,68 g
mddH2SO4=\(\dfrac{mct.100\%}{C\%}=\dfrac{6,68.100\%}{1,96\%}=350g\)
mdd(sau-phan-ung) = mhh + mddH2SO4 - mH2 = 1,41 +350 - (0,07.2)=351,27 g
Theo pthh 1
nAl2(SO4)3=1/2nAl=1/2.0,03=0,015 mol
->mAl2(SO4)3=0,015.342=5,13 g
Theo pthh 2
nMgSO4=nMg=0,025 mol
->mMgSO4=0,025.120=3g
\(\Rightarrow\) C%\(_{Al2\left(SO4\right)3}=\dfrac{5,13}{351,27}.100\%\approx1,46\%\)
C%MgSO4=\(\dfrac{3}{351,27}.100\%\approx0,854\%\)
Đúng 0
Bình luận (0)
Bài làm:
PTHH: (1) 2Al + 3H2SO4 -> Al2(SO4)3 +3H2
(2) Mg + H2SO4 -> MgSO4 + H2
- Gọi x,y lần lượt là số mol của Al,Mg trong hỗn hợp hai kim loại ban đầu (mol)
=> \(=>\left\{{}\begin{matrix}m_{Al}=27x\left(g\right)\\m_{Mg}=24y\left(g\right)\end{matrix}\right.\\ =>m_{hh}=m_{Al}+m_{Mg}\\ < =>1,41=27x+24y\left(g\right)->\left(a\right)\)
Theo PTHH, ta có:
\(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=1,5x\left(mol\right)\\n_{H_2\left(2\right)}=y\left(mol\right)\end{matrix}\right.\\ =>n_{H_2\left(1\right)}+n_{H_2\left(2\right)}=\Sigma n_{H_2}\\ < =>1,5x+y=\dfrac{1568}{22,4.1000}=0,07\left(mol\right)->\left(b\right)\)
Từ (a), (b), ta có hệ phương trình:
\(\left\{{}\begin{matrix}27x+24y=1,41\\1,5x+y=0,07\end{matrix}\right.\)
Giaỉ hệ phương trình ta được: x=0,03; y= 0,025
=> \(n_{Al\left(1\right)}=x=0,03\left(mol\right)\\ n_{Mg\left(2\right)}=y=0,025\left(mol\right)\)
- Chất có trong dd thu dc sau phản ứng gồm: Al2(SO4)3 và MgSO4
Theo các PTHH và đề bài, ta có:
- \(n_{H_2SO_4\left(1\right)}=n_{H_2\left(1\right)}=\dfrac{3.0,03}{2}=0,045\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{0,03}{2}=0,015\left(mol\right)\\ =>\left\{{}\begin{matrix}m_{H_2\left(1\right)}=0,045.2=0,09\left(g\right)\\m_{H_2SO_4\left(1\right)}=0,045.98=4,41\left(g\right)\\m_{Al_2\left(SO_4\right)_3}=0,015.342=5,13\left(g\right)\end{matrix}\right.\)
- \(n_{H_2SO_4\left(2\right)}=n_{MgSO_4\left(2\right)}=n_{H_2\left(2\right)}=n_{Mg\left(2\right)}=0,025\left(mol\right)\\ =>\left\{{}\begin{matrix}m_{H_2SO_4\left(2\right)}=0,025.98=2,45\left(g\right)\\m_{MgSO_4\left(2\right)}=0,025.120=3\left(g\right)\\m_{H_2\left(2\right)}=0,025.2=0,05\left(g\right)\end{matrix}\right.\)
- Ta lại có: \(\Sigma m_{H_2SO_4}=m_{H_2SO_4\left(1\right)}+m_{H_2SO_4\left(2\right)}=4,41+2,45=6,86\left(g\right)\\
=>m_{ddH_2SO_4}=\dfrac{6,86.100}{1,96}=350\left(g\right)\)
=> \(m_{dd-sau-phản-ứng}=m_{ddH_2SO_4}+m_{hh-kim-loại}-\left(m_{H_2\left(1\right)}+m_{H_2\left(2\right)}\right)\\
=350+1,41-\left(0,09+0,05\right)=351,27\left(g\right)\)
=> \(C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{5,13}{351,27}.100\approx1,46\%\\ C\%_{ddMgSO_4}=\dfrac{3}{351,27}.100\approx0,854\%\)
________________________Bài dài quá____________________
XONG
Đúng 1
Bình luận (13)
Khi trình bày chú ý trình bày ngắn gọn, dễ quan sát thôi. Nên viết số mol của các chất bên dưới phương trình luôn. Cô sẽ chữa cho một bài mẫu nhé.
Gọi số mol của Mg, Al lần lượt là x và y.
\(n_{H2}=0,07mol\)
Mg + H2SO4 \(\rightarrow\) MgSO4 + H2
x ...........x................. x..........x
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2
y ..........\(\dfrac{3}{2}y\)...............\(\dfrac{1}{2}y\) ............\(\dfrac{3}{2}y\)
Từ 2 pt \(\Rightarrow n_{H2SO4}=n_{H2}=0,07mol\\ \Rightarrow m_{ddH2SO4}=\dfrac{0,07.98}{1,96\%}=350gam\)
\(\Rightarrow m_{ddsau}=m_{ddH2SO4}+m_{KL}-m_{H2}=350+1,41-0,07.2=351,27\)
Ta có hệ \(\left\{{}\begin{matrix}24x+27y=1,41\\x+\dfrac{3}{2}y=0,07\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,025\\y=0,03\end{matrix}\right.\)
\(\left\{{}\begin{matrix}C_{\%MgSO4}=\dfrac{0,025.120}{351,27}.100\%=0,854\%\\C_{\%Al2\left(SO4\right)3}=\dfrac{0,015.342}{351,27}.100\%=1,460\%\end{matrix}\right.\)
Đúng 0
Bình luận (2)
Cho 5,1 gam hỗn hợp Al và Mg tác dụng với lượng vừa đủ dung dịch H2SO4 9,8%, sau phản ứng thu được 5,6 lít khí H2 (ở đktc)
(a) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu.
(b) Tính nồng độ phần trăm của dung dịch X
a)\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: x 1,5x
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}27x+24y=5,1\\1,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27.100\%}{5,1}=52,94\%;\%m_{Mg}=100-52,94=47,06\%\)
b)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,1 0,15 0,05
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{ddH_2SO_4}=\dfrac{\left(0,1+0,15\right).98.100}{9,8}=250\left(g\right)\)
mdd sau pứ = 5,1+250-0,15.2 = 254,8(g)
\(C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342.100\%}{254,8}=6,71\%\)
\(C\%_{ddMgSO_4}=\dfrac{0,1.120.100\%}{254,8}=4,71\%\)
Đúng 3
Bình luận (0)
Câu 5: Cho 5,1 gam hỗn hợp Al và Mg tác dụng với lượng vừa đủ dung dịch H2SO4 9,8%, sau phản ứng thu được 5,6 lít khí H2 (ở đktc) a. Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu. b. Tính nồng độ phần trăm của dung dịch X. Giúp mình với các b ơi
\(a.n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ Đặt:\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ \rightarrow\left\{{}\begin{matrix}27a+24b=5,1\\1,5a+b=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \left\{{}\begin{matrix}\%m_{Al}=\dfrac{27.0,1}{5,1}.100\approx52,941\%\\\%m_{Mg}\approx47,059\%\end{matrix}\right.\)
\(b.m_{ddH_2SO_4}=\dfrac{0,25.98.100}{9,8}=250\left(g\right)\\ m_{ddsau}=m_{Al,Mg}+m_{ddH_2SO_4}-m_{H_2}=5,1+250-0,25.2=254,6\left(g\right)\\ C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342}{254,6}.100\approx6,716\%\\ C\%_{ddMgSO_4}=\dfrac{0,1.120}{254,6}.100\approx4,713\%\)
Đúng 2
Bình luận (3)
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho 18,7 gam X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và 6,72 lít khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được 18,0 gam chất rắn. Mặt khác, khi cho 18,7 gam hỗn hợp X vào 500 ml dung dịch CuCl2 1,0M, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được 65,0 gam muối khan. Biết các phản ứng hóa học xảy r...
Đọc tiếp
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho 18,7 gam X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và 6,72 lít khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được 18,0 gam chất rắn. Mặt khác, khi cho 18,7 gam hỗn hợp X vào 500 ml dung dịch CuCl2 1,0M, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được 65,0 gam muối khan. Biết các phản ứng hóa học xảy ra hoàn toàn.
Xác định kim loại M và tính thành phần phần trăm theo khối lượng của các chất có trong hỗn hợp X.
Cho 3,64 gam hỗn hợp E gồm một oxit, một hiđroxit và một muối cacbonat trung hòa của một kim loại M có hóa trị II tác dụng vừa đủ với 117,6 gam dung dịch H2SO4 10%. Sau phản ứng, thu được 0,448 lít khí (đktc) và dung dịch muối duy nhất có nồng độ 10,867% (khối lượng riêng là 1,093 gam/ml); nồng độ mol là 0,545M. a) Viết các phương trình phản ứng xảy ra và xác định kim loại M. b) Tính % khối lượng của các chất có trong hỗn hợp E.
Đọc tiếp
Cho 3,64 gam hỗn hợp E gồm một oxit, một hiđroxit và một muối cacbonat trung hòa của một kim loại M có hóa trị II tác dụng vừa đủ với 117,6 gam dung dịch H2SO4 10%. Sau phản ứng, thu được 0,448 lít khí (đktc) và dung dịch muối duy nhất có nồng độ 10,867% (khối lượng riêng là 1,093 gam/ml); nồng độ mol là 0,545M.
a) Viết các phương trình phản ứng xảy ra và xác định kim loại M.
b) Tính % khối lượng của các chất có trong hỗn hợp E.
a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
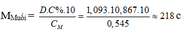
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
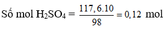
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%
Đúng 0
Bình luận (0)
7,5 gam hỗn hợp X gồm Al, Mg tác dụng với dung dịch HCl 14,6% (vừa đủ) thu được 7,84 lít khí (đktc) và dung dịch Y.
a) Viết phương trình hóa học xảy ra.
b) Tính thành phần % khối lượng của mỗi kim loại có trong hỗn hợp X.
c) Tính khối lượng dung dịch HCl cần dùng
d) Tính nồng độ phần trăm các chất trong dung dịch sau phản ứng.
\(a.2Al+6HCl->2AlCl_3+3H_2\\ Mg+2HCl->MgCl_2+H_2\\ b.n_{Al}=a,n_{Mg}=b\\ 27a+24b=7,5\left(I\right)\\ 1,5a+b=\dfrac{7,84}{22,4}=0,35\left(II\right)\\ a=0,1;b=0,2\\ \%m_{Al}=\dfrac{27\cdot0,1}{7,5}\cdot100\%=36\%\\ \%m_{Mg}=64\%\\ c.m_{HCl}=36,5\left(0,1\cdot3+0,2\cdot2\right)=18,25g\\ d.m_{ddsau}=7,5+\dfrac{18,25}{14,6:100}-0,35\cdot2=131,8g\\ C\%\left(AlCl_3\right)=\dfrac{133,5\cdot0,1}{131,8}\cdot100\%=10,1\%\\ C\%\left(MgCl_2\right)=\dfrac{95\cdot0,2}{131,8}\cdot100\%=14,4\%\)
Đúng 4
Bình luận (0)
: Cho 11 gam hỗn hợp hai kim loại Al và Fe tác dụng vừa đủ với V ml dd H2SO4 0,2M, sau phản ứng thu được dung dịch X và khí Y. Cho dung dịch X tác dụng vừa đủ với dung dịch NaOH 10%, thì khối lượng kết tủa lớn nhất thu được là 24,6 gam.a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?b/ Tính V?c/ Tính khối lượng dung dịch NaOH cần dùng ở trên?d/ Đem kết tủa nung ngoài không khí đến khối lượng không đổi thì thu được bao nhiêu gam chất rắn?
Đọc tiếp
: Cho 11 gam hỗn hợp hai kim loại Al và Fe tác dụng vừa đủ với V ml dd H2SO4 0,2M, sau phản ứng thu được dung dịch X và khí Y. Cho dung dịch X tác dụng vừa đủ với dung dịch NaOH 10%, thì khối lượng kết tủa lớn nhất thu được là 24,6 gam.
a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
b/ Tính V?
c/ Tính khối lượng dung dịch NaOH cần dùng ở trên?
d/ Đem kết tủa nung ngoài không khí đến khối lượng không đổi thì thu được bao nhiêu gam chất rắn?
\(a,\) Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\)
\(\Rightarrow 27x+56y=11(1)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ Al_2(SO_4)_3+6NaOH\to 2Al(OH)_3\downarrow+3Na_2SO_4\\ FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{Al(OH)_3}=x;n_{Fe(OH)_2}=y\\ \Rightarrow 78x+90y=24,6(2)\\ (1)(2)\Rightarrow \begin{cases} x=0,2(mol)\\ y=0,1(mol) \end{cases} \Rightarrow \begin{cases} m_{Al}=0,2.27=5,4(g)\\ m_{Fe}=11-5,4=5,6(g) \end{cases}\)
\(b,\Sigma n_{H_2SO_4}=1,5x+y=0,4(mol)\\ \Rightarrow V_{dd_{H_2SO_4}}=\dfrac{0,4}{0,2}=2(l)\\ c,\Sigma n_{NaOH}=3x+2y=0,8(mol)\\ \Rightarrow m_{dd_{NaOH}}=\dfrac{0,8.40}{10\%}=320(g)\\ d,2Al(OH)_3\xrightarrow{t^o}Al_2O_3+3H_2O\\ Fe(OH)_2\xrightarrow{t^o}FeO+H_2O\\ \Rightarrow n_{Al_2O_3}=0,1(mol);n_{FeO}=0,1(mol)\\ \Rightarrow m_{\text{chất rắn}}=0,1.102+0,1.72=17,4(g)\)
Đúng 1
Bình luận (0)
Hỗn hợp X1 gồm Fe, FeCO3 và kim loại M ( có hóa trị không đổi). Cho 14,1 gam X1 tác dụng với 500 ml dung dịch HNO3 xM, thu được dung dịch X2 và 4,48 lít hỗn hợp Y1 ( có tỉ khối so với hidro là 16,75) gồm hai chất khí không màu trong đó có một khí hóa nâu ngoài không khí. Để trung hòa HNO3 dư có trong dung dịch X2 cần vừa đủ 200 ml dung dịch NaOH 1M và thu được dung dịch X3. Chia X3 làm hai phần bằng nhau: – Phần 1: đem cô cạn thì thu được 38,3 gam hỗn hợp muối khan. – Phần 2: Cho tác dụng với du...
Đọc tiếp
Hỗn hợp X1 gồm Fe, FeCO3 và kim loại M ( có hóa trị không đổi). Cho 14,1 gam X1 tác dụng với 500 ml dung dịch HNO3 xM, thu được dung dịch X2 và 4,48 lít hỗn hợp Y1 ( có tỉ khối so với hidro là 16,75) gồm hai chất khí không màu trong đó có một khí hóa nâu ngoài không khí. Để trung hòa HNO3 dư có trong dung dịch X2 cần vừa đủ 200 ml dung dịch NaOH 1M và thu được dung dịch X3. Chia X3 làm hai phần bằng nhau:
– Phần 1: đem cô cạn thì thu được 38,3 gam hỗn hợp muối khan.
– Phần 2: Cho tác dụng với dung dịch NaOH dư thì thu được 8,025 gam kết tủa của 1 chất.
Biết các phản ứng đều xảy ra hoàn toàn, các chất khí đều đo ở đktc, quá trình cô cạn không xảy ra phản ứng hóa học. Giá trị của x gần với giá trị nào sau đây?
A. 2,26
B. 2,42
C. 2,31
D. 1,98
Đáp án C
* Hỗn hợp gồm kim loại M, Fe, FeCO3 tác dụng với dung dịch HNO3 thu được 2 khí không màu trong đó có 1 khí hóa nâu ngoài không khí nên 2 khí là NO và CO2
Tính được nCO2=0,05 mol, n(NO)=0,15 mol nên n(FeCO3)=n(CO2)=0,05 mol.
Đặt nM=a mol, nên n(Fe)=b mol. Ta có: aM+56b+116.0,05=14,1
Nên aM+56b=8,3 (1)
- Dung dịch X2 có : a mol M(NO3)n; (b+0,05) mol Fe(NO3)3, HNO3 dư, có thể có c mol NH4NO3.
+ Phản ứng trung hòa:
HNO3+NaOH→NaNO3+H2O
n(NaOH)= n (HNO3dư)=0,2.1=0,2 mol
- dung dịch X3 có a mol M(NO3)n,( b+0,05) mol Fe(NO3)3, 0,2 mol NaNO3, có thể c mol NH4NO3.
* Cô cạn ½ dung dịch X3, tổng khối lượng chất rắn thu được là:
(M+62n)a+242(b+0,05)+80.c+85.0,2=38,3.2=76,6
aM+62an+242b+80c=47,5 (2)
* Cho dung dịch NaOH dư và ½ dung dịch X3 thu được kết tủa của một chất đó là Fe(OH)3
Fe(NO3)3+3NaOH→3NaNO3+Fe(OH)3
Ta có: 107(b+0,05)=16,05 suy ra b=0,1
Theo bảo toàn electron, ta có: an+ 0,3+0,05=0,45+8c suy ra an=0,1+8c (5)
Từ (1) suy ra aM=2,7 (6)
Từ (2) aM+62an+80c=23,3 (7)
Từ (5), (6), (7) an=0,3; c=0,025 M=9n n=3; M=27 là Al là nghiệm thỏa mãn.
n(HNO3 phản ứng)=nN(sp)=0,1.3+0,15.3+0,025.2+0,15=0,95mol
n(HNO3 bắt đầu)=0,95+0,2=1,15 mol x= CM(HNO3)=2,3M.
Đúng 0
Bình luận (0)
Hỗn hợp
X
1
gồm
Fe
,
FeCO
3
và kim loại M (có hóa trị không đổi). Cho 14,1 gam
X
1
tác dụng với 500 ml dung dịch
HNO
3
xM, thu được dung dịch
X
2
và 4,48 lít hỗn hợp
Y
1
(có tỉ khối so với hiđro là 16,75) gồm hai c...
Đọc tiếp
Hỗn hợp X 1 gồm Fe , FeCO 3 và kim loại M (có hóa trị không đổi). Cho 14,1 gam X 1 tác dụng với 500 ml dung dịch HNO 3 xM, thu được dung dịch X 2 và 4,48 lít hỗn hợp Y 1 (có tỉ khối so với hiđro là 16,75) gồm hai chất khí không màu trong đó có một khí hóa nâu ngoài không khí. Để trung hòa HNO 3 dư có trong dung dịch X 2 cần vừa đủ 200 ml dung dịch NaOH 1M và thu được dung dịch X 3 . Chia X 3 làm hai phần bằng nhau: - Phần 1: đem cô cạn thì thu được 38,3 gam hỗn hợp muối khan. - Phần 2: Cho tác dụng với dung dịch NaOH dư thì thu được 8,025 gam kết tủa của 1 chất. Biết các phản ứng đều xảy ra hoàn toàn, các chất khí đều đo ở đktc, quá trình cô cạn không xảy ra phản ứng hóa học. Giá trị của x gần với giá trị nào sau đây?
A. 2,26
B. 2,42
C. 2,31
D. 1,98




















